(64) 9 9989 9911


A Covid-19 continuou a ceifar vidas em 2023 – matando mais de 50 mil pacientes somente nos Estados Unidos e elevando o número global de mortes para quase sete milhões de pessoas. A pandemia também criou uma epidemia de sobreviventes que continuam a sofrer com Covid longa. Mas nem todas as notícias são ruins em 2023, pelo contrário: a ciência ligada à saúde realizou importantes descobertas que dão esperança em muitas áreas.
Com mais pessoas se tornando imunes ao vírus, a OMS (Organização Mundial da Saúde) decidiu, em 5 de maio, que a Covid-19 não constitui mais uma emergência de saúde pública de interesse internacional. Os reforços atualizados das vacinas existentes ajudaram a reduzir o número de casos, hospitalizações e mortes.
Além das vacinas contra a Covid-19, houve muitas outras descobertas interessantes e inovadoras feitas este ano, algumas das quais são especialmente notáveis por seu possível impacto na saúde e na medicina.
A primeira terapia genética do mundo baseada em CRISPR foi aprovada pelos órgãos reguladores de medicamentos no Reino Unido em 16 de novembro e nos Estados Unidos em 8 de dezembro. Ela trata a doença falciforme e a beta-talassemia, distúrbios genéticos que afetam as células vermelhas do sangue.
A hemoglobina, encontrada nas células vermelhas do sangue, transporta oxigênio pelo corpo. Os erros nos genes da hemoglobina criam glóbulos vermelhos frágeis que causam falta de oxigênio no corpo, uma condição conhecida como anemia. Os pacientes com doença falciforme também sofrem de infecções e dores fortes quando as células falciformes formam coágulos e impedem o fluxo sanguíneo, enquanto os pacientes com talassemia beta precisam receber transfusão de sangue a cada três ou quatro semanas.
A terapia genética recém-aprovada, denominada CASGEVY, corrige os genes defeituosos da hemoglobina nas células-tronco da medula óssea do paciente para que elas possam produzir hemoglobina funcional. As células-tronco do paciente são colhidas da medula óssea, editadas em um laboratório e, em seguida, infundidas novamente no paciente. Um único tratamento pode potencialmente curar alguns pacientes para o resto da vida.
Emmanuelle Charpentier e Jennifer Doudna, duas inventoras que ajustaram o CRISPR (abreviação de "clustered regularly interspaced short palindromic repeats") para funcionar como uma ferramenta precisa de edição de genes, receberam o Prêmio Nobel de Química há apenas três anos, em 2020.
Esse é apenas o primeiro de dezenas de possíveis tratamentos em desenvolvimento para tratar outras doenças genéticas, câncer ou até mesmo infertilidade.
A Administração de Alimentos e Medicamentos dos Estados Unidos aprovou o primeiro medicamento para Alzheimer que tem como alvo uma das causas subjacentes da doença. Embora o medicamento, Leqembi, não seja uma cura nem melhore os sintomas no estágio final da doença, após 18 meses de tratamento ele retarda o declínio da memória e do raciocínio em cerca de 30% se o medicamento for administrado no estágio inicial da doença.
O Leqembi é um anticorpo monoclonal que atua tendo como alvo as placas amiloides no cérebro, que são uma característica marcante da doença de Alzheimer. Quando níveis anormais de uma proteína que ocorre naturalmente, chamada beta amiloide, se aglomeram para formar placas pegajosas no cérebro, elas desencadeiam inflamação e danificam as conexões neuronais. O acúmulo de placas amiloides leva à perda de memória e de pensamento, causando a doença de Alzheimer.
Os estudos clínicos indicam que o Leqembi remove as placas amiloides do cérebro, o que retarda a progressão da doença.
Sim, você leu certo. Pesquisadores do Japão apresentaram evidências em uma conferência científica de que é possível reproduzir camundongos saudáveis e férteis sem um óvulo de um camundongo fêmea.
Primeiro, os óvulos foram produzidos a partir de células-tronco derivadas das células da pele de um camundongo macho. Esses óvulos foram fertilizados com esperma de outro macho e, em seguida, o óvulo fertilizado foi transferido para uma camundonga fêmea, onde cresceu e amadureceu.
Embora apenas sete dos mais de 600 embriões implantados tenham se desenvolvido em camundongos bebês, os filhotes cresceram normalmente e foram férteis quando adultos.
Ainda não se sabe se os filhotes de camundongos se desenvolverão exatamente como os nascidos por meio de reprodução convencional. Essas descobertas ainda não foram publicadas em um periódico revisado por pares e, até o momento, etapas preliminares semelhantes falharam em humanos.
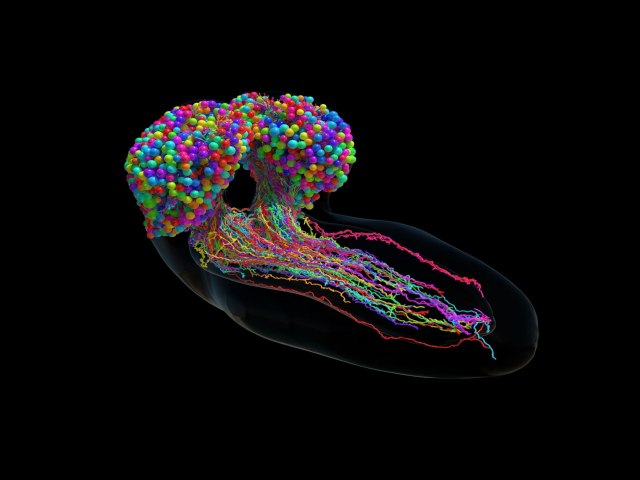
Os cientistas produziram o primeiro diagrama completo da fiação de conexões cerebrais de um cérebro de inseto. Isso pode não parecer impressionante, mas o cérebro, mesmo o de uma mosca-das-frutas, contém vastas redes de neurônios interconectados, chamadas de conectoma.
Até agora, apenas os cérebros de uma lombriga, de um esguicho-do-mar e de um verme marinho foram completamente mapeados; cada um deles contém apenas algumas centenas de conexões.
Mas um mapa completo do conectoma de uma larva de mosca-das-frutas revela que ela contém mais de três mil neurônios e mais de meio milhão de conexões entre eles. O desenvolvimento desse mapa levou mais de cinco anos para uma equipe internacional de cientistas. Embora o cérebro da mosca-das-frutas seja muito mais simples do que o dos seres humanos, as técnicas desenvolvidas ajudarão a mapear cérebros mais complexos no futuro.
Os circuitos neurais no cérebro da mosca-das-frutas são semelhantes às redes neurais usadas no aprendizado de máquina. A compreensão das semelhanças e complexidades do conectoma do cérebro da mosca pode ajudar a decifrar como o cérebro humano funciona e como as doenças neurológicas se desenvolvem. Isso também pode levar ao desenvolvimento de novos métodos de aprendizado de máquina e sistemas de inteligência artificial mais eficientes.
Os cientistas demonstram que, quando as células produtoras de pigmento, chamadas melanócitos, ficam presas em um estado imaturo, elas não conseguem desenvolver a cor loira, marrom, vermelha ou preta do cabelo. Esse estado de paralisação leva ao envelhecimento dos cabelos. O cabelo novo cresce a partir dos folículos encontrados na pele, onde também residem os melanócitos.
Os cientistas da Universidade de Nova York, nos Estados Unidos, observaram células-tronco de melanócitos individuais migrarem para cima e para baixo no folículo piloso individual de camundongos ao longo de dois anos. Para sua surpresa, eles descobriram que as células-tronco dos melanócitos podem alternar entre células-tronco imaturas cinzentas e células coloridas maduras à medida que sobem e descem durante o ciclo de vida do cabelo.
Mas à medida que o cabelo envelhece, as células-tronco dos melanócitos ficam lentas após vários ciclos e ficam presas perto da base do cabelo como melanócitos imaturos. E sem a produção de pigmento, o cabelo fica branco.
Os cientistas descobriram que algumas bactérias frequentemente encontradas em muitos tumores do trato gastrointestinal ajudam diretamente as células cancerosas a evitar a resposta imunológica do corpo.
Essas bactérias não apenas cooperam com as células tumorais para promover a progressão do câncer, mas também as ajudam a se espalhar mais rapidamente, quebrando os medicamentos anticâncer e fazendo com que o tratamento falhe.
Essa pesquisa sugere que alguns medicamentos anticâncer são eficazes porque também matam as bactérias que habitam o tumor. A compreensão de como o microambiente do tumor afeta sua sobrevivência e progressão pode abrir novas portas para o tratamento do câncer.
Uma nova ferramenta de inteligência artificial (IA) pode prever o câncer de pâncreas até três anos antes do diagnóstico real, identificando padrões específicos de condições que ocorreram nos registros de saúde dos pacientes.
O câncer de pâncreas é raro, mas é a terceira maior causa de mortes relacionadas ao câncer. Ele é tão mortal porque geralmente é detectado nos estágios finais, quando a doença já se espalhou para outras áreas do corpo.
Os sintomas do câncer de pâncreas em estágio inicial são facilmente diagnosticados erroneamente, mas muitos pacientes poderiam viver mais se o câncer fosse detectado precocemente. Isso levou os cientistas a treinar um algoritmo de IA nos registros médicos de 6,2 milhões de pessoas da Dinamarca, durante 41 anos, para detectar os padrões ocultos nos registros de 24 mil pacientes que posteriormente desenvolveram câncer de pâncreas.
Nos registros médicos, cada doença é registrada com um código. O modelo de IA analisou as combinações desses códigos de doenças e o momento de sua ocorrência. Ao comparar sequências específicas de condições que precederam o diagnóstico de câncer de pâncreas, o modelo de IA aprendeu a identificar as pessoas com maior risco de contrair a doença.
Em seguida, os cientistas testaram a ferramenta de IA analisando os registros de quase 3 milhões de veteranos dos Estados Unidos ao longo de 21 anos. O algoritmo de computador identificou corretamente quase 4 mil indivíduos, até três anos antes de eles serem realmente diagnosticados com câncer de pâncreas. O estudo mostra que os modelos de IA podem ser tão precisos quanto os testes genéticos na previsão do risco de câncer de pâncreas. Como o câncer de pâncreas é muito raro, a triagem genética é atualmente recomendada apenas para indivíduos de alto risco ou para aqueles com histórico familiar da doença.